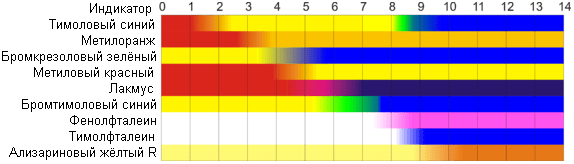
Naturalne wskaźniki pH
Pod wpływem zmian reakcji środowiska nie tylko związki stosowane w laboratoriach jako wskaźniki nabierają różnych barw. Równie dużą grupę stanowią substancje zawarte w produktach naturalnych. W kilku testach przetestujemy zachowanie wskaźników pH w naszym środowisku.
Do przeprowadzenia eksperymentów będziesz potrzebować kilku roztworów o różnym pH. Można je otrzymać przez rozcieńczenie kwasu solnego HCl (pH 3-4% roztworu wynosi 0) i roztworu wodorotlenku sodu NaOH (4% roztwór ma pH 14). Woda destylowana, której również będziemy używać, ma pH 7 (neutralne). W badaniu wykorzystamy sok z buraków, sok z czerwonej kapusty, sok z jagód oraz napar herbaciany.
Do probówek z przygotowanymi roztworami i wodą destylowaną wlać odrobinę soku z buraków ćwikłowych (zdjęcie 1). W roztworach kwaśnych nabiera intensywnej czerwonej barwy, w roztworach obojętnych i zasadowych barwa staje się brązowa przechodząc w żółty odcień (zdjęcie 2). Ten ostatni kolor jest wynikiem rozkładu barwnika w środowisku silnie zasadowym. Substancją odpowiedzialną za zmianę koloru soku z buraków jest betanina. Zakwaszający barszcz lub sałatka z buraków to kulinarny trik, który nada potrawie apetyczny kolor.
Spróbuj soku z czerwonej kapusty w ten sam sposób (zdjęcie 3). W roztworze kwaśnym sok staje się jaskrawoczerwony, w roztworze obojętnym staje się jasnofioletowy, aw roztworze zasadowym staje się zielony. Również w tym przypadku mocna zasada rozkłada barwnik – płyn w probówce żółknie (zdjęcie 4). Substancjami zmieniającymi kolor są antocyjany. Skropienie sałatki z czerwonej kapusty sokiem z cytryny nadaje jej atrakcyjny wygląd.
W innym eksperymencie potrzebny jest sok z jagód (zdjęcie 5). Barwa czerwono-fioletowa zmienia się na czerwoną w środowisku kwaśnym, na zieloną w środowisku zasadowym i na żółtą w środowisku silnie zasadowym (rozkład barwnika) (zdjęcie 6). Tutaj również antocyjany odpowiadają za zmianę koloru soku.
Napar herbaciany można również stosować jako wskaźnik pH roztworu (zdjęcie 7). W obecności kwasów kolor staje się słomkowożółty, w środowisku obojętnym staje się jasnobrązowy, aw środowisku zasadowym staje się ciemnobrązowy (zdjęcie 8). Pochodne garbników odpowiadają za zmianę koloru naparu, nadając herbacie charakterystyczny cierpki smak. Dodatek soku z cytryny sprawia, że napar nabiera jaśniejszego koloru.
Warto też samodzielnie przeprowadzić badania z innymi naturalnymi wskaźnikami – wiele soków i wywarów roślinnych zmienia barwę na skutek zakwaszenia lub alkalizacji środowiska.
Zobacz to na wideo:
Naturalne wskaźniki pH
